(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.已知:N2(g)+2H2(g)═N2H4(l)△H=+506kJ•mol-1;2H2(g)+O2(g)═2H2O(l)△H=-
问题描述:
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
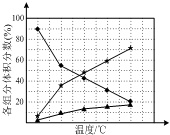
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
最佳答案:
(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O,
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4催化剂.△N2+4NH3,
故答案为:3N2H4催化剂.△N2+4NH3;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=43×0.97714:43×0.0231=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
56x+76y=15.6
解得:x:y=9:1,
故答案为:9:1.
上一篇:(1)考古发掘出的铜器表面往往有一层厚厚的铜绿〔主要成分Cu2(OH)2CO3〕,试用化学方程式解释铜绿形成的原因.(2)为什么高档电器的铜质插孔、插头表面要镀上价格比铜昂
-
![[问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰](/public/static/common/images/not_adv.jpg) [问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰
[问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰 -
![[问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰](/public/static/common/images/not_adv.jpg) [问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰
[问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰 -
![[问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰](/public/static/common/images/not_adv.jpg) [问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰
[问答题] 阅读《论毅力》开头一段文字:天下古今成败之林,若是其莽然不一途也。要其何以成,何以败?曰 -
![[问答题] 阅读《炉中煤》的第三节。啊,我年青的女郎我想我的前身原本是有用的栋梁,我活埋在地底多年到](/public/static/common/images/not_adv.jpg) [问答题] 阅读《炉中煤》的第三节。啊,我年青的女郎我想我的前身原本是有用的栋梁,我活埋在地底多年到
[问答题] 阅读《炉中煤》的第三节。啊,我年青的女郎我想我的前身原本是有用的栋梁,我活埋在地底多年到 -
![[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死,](/public/static/common/images/not_adv.jpg) [问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死,
[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死, -
![[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死,](/public/static/common/images/not_adv.jpg) [问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死,
[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死, -
![[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死,](/public/static/common/images/not_adv.jpg) [问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死,
[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:狗彘食人食而不知检,涂有饿莩而不知发;人死, -
![[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:不违农时,谷不可胜食也;数罟不入湾池,鱼鳖不](/public/static/common/images/not_adv.jpg) [问答题] 阅读《寡人之于国也》中的一段文字,回答问题:不违农时,谷不可胜食也;数罟不入湾池,鱼鳖不
[问答题] 阅读《寡人之于国也》中的一段文字,回答问题:不违农时,谷不可胜食也;数罟不入湾池,鱼鳖不
最新更新
- 如果dx,dm分别代表出口的需求弹性和进口的需求弹性,则马歇尔—勒纳条件用公式表示为()
- 偏移寻址通过将某个寄存器内容与一个形式地址相加而生成有效地址。下列寻址方式中,不属于偏移寻址方式的是
- 以下( )是不正确的字符串常量
- [问答题] 黑仔、蓝魂儿是怎么死的?
- [问答题] 鲁迅在《灯下漫笔》中所说的中国“固有文明”的实质是什么?
- [问答题] 高尔基《鹰之歌》的主题是什么?
- [问答题] 驼业种树,凡长安豪富人为观游及卖果者,皆争迎取养。视驼所种树,或移徙,无不活,且硕茂、早
- [问答题] 驼业种树,凡长安豪富人为观游及卖果者,皆争迎取养。视驼所种树,或移徙,无不活,且硕茂、早
- [问答题] 陶渊明《饮酒》:“结庐在人境,而无车马喧;问君何能尔,心远地自偏”(1)这四句陈述了什么
- [问答题] 阅读庄子《秋水》中的一段文字:计四海之在天地之间也,不似礨空之在大泽乎?计中国之在海内,
推荐阅读
猜你喜欢
关注我们


 财经类
财经类  计算机类
计算机类  建筑工程
建筑工程  外贸考试
外贸考试  学历类
学历类  学生作业
学生作业  医学类
医学类  招录类
招录类  资格类
资格类  网站首页
网站首页